Hodentumoren
AG Bremmer
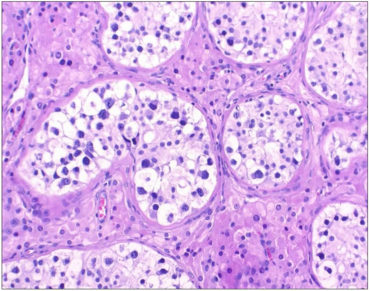
Obwohl sie mit einem Anteil von etwa 1% aller bösartigen Tumoren des erwachsenen Mannes eine Rarität sind, stellen Hodentumoren für den Pathologen aufgrund ihrer morphologischen Vielfalt eine diagnostische Herausforderung dar. Der Begriff „Hodentumor“ wird im medizinischen Alltag allgemein als Synonym für Keimzelltumoren verwendet, nicht ganz zu Unrecht, da Keimzelltumoren etwa 90% aller intraskrotalen Tumoren repräsentieren. Die übrigen 10% der Tumoren, die im Hoden oder im anhängenden Gewebe auftreten können, sind, mit Ausnahme der Tumoren des Keimstrang-Gonadenstromas, absolute Raritäten und spielen in der klinischen Medizin nur für die betroffenen Patienten eine wichtige Rolle. Das heißt aber, dass die überwiegende Zahl der Pathologen sowohl Keimzelltumoren als auch andere Hodentumoren nur selten zu sehen bekommt.
Die Inzidenz der Keimzelltumoren ist in den letzten Jahren stetig gestiegen, sie repräsentieren in der Altersgruppe zwischen dem 15. und 45. Lebensjahr den häufigsten malignen Tumor des jungen Mannes. Die Mortalitätsrate konnte mit Einführung der Platinderivate dramatisch gesenkt werden, so dass heute über 90% der Patienten selbst im metastasierten Zustand geheilt werden können.
English version
Although they are a rarity with about 1% of all malignant tumors of the adult male, testicular tumors represent a diagnostic challenge for the pathologist due to their morphological diversity. The incidence of germ cell tumors has increased steadily in recent years and they represent the most common malignant tumor in the young man between the ages of 15 and 45. The mortality rate could be reduced dramatically with the introduction of platinum derivatives, so that today over 90% of patients can be cured even in the metastatic state.
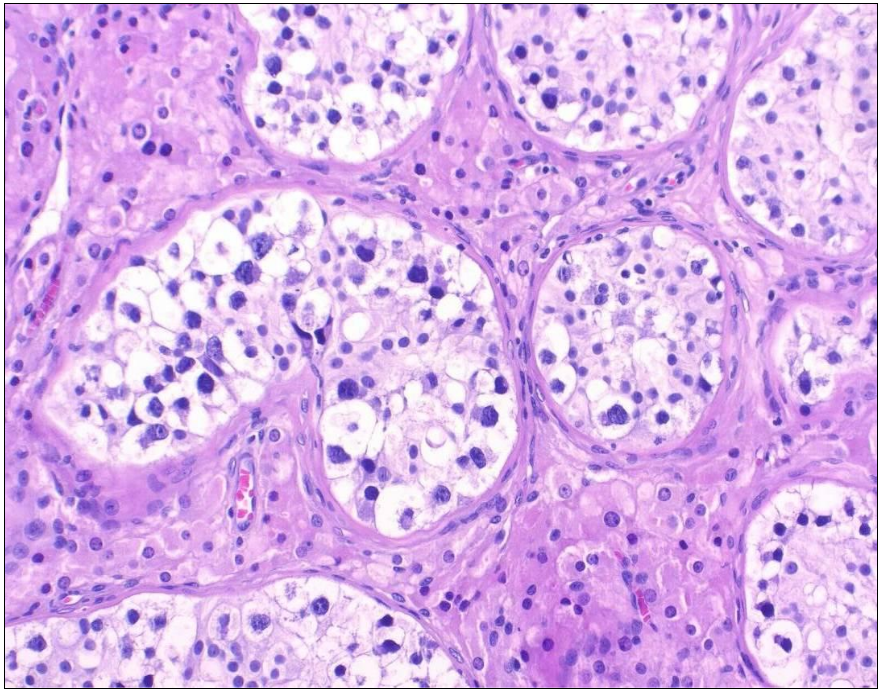
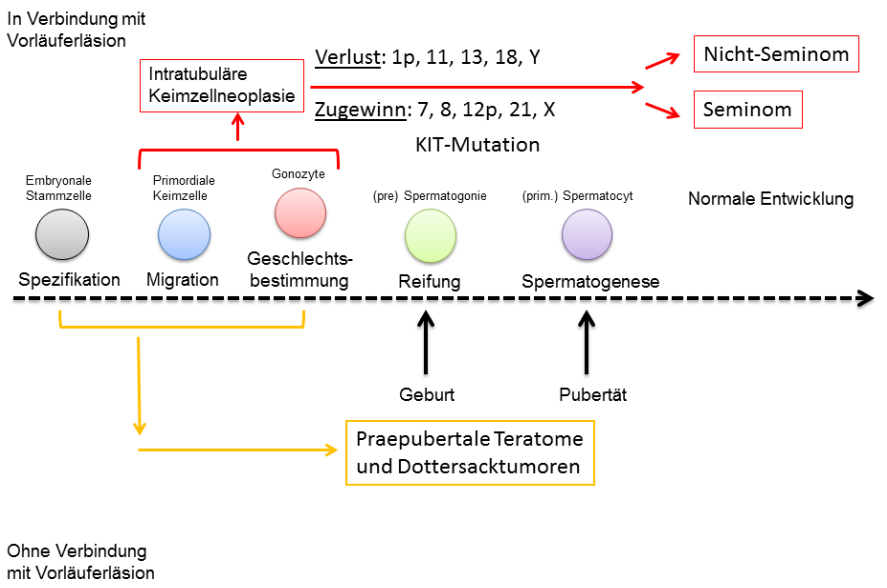
Germ cell neoplasia in situ (germ cell neoplasia in situ, GCNIS, Figure 1), in which the tumor cells remain confined to the testicular tubules, is regarded as a reliable precursor lesion. If atypical germ cells break through the testicular tubules and infiltrate the surrounding tissue, invasive germ cell tumors arise. The reason for the development of GCNIS is assumed to be that primordial germ cells / gonocytes do not differentiate into spermatogonia (Figure 2). An important molecular change is the gain of chromosomal "material" on chromosome 12, usually in the form of an isochromesome 12p.
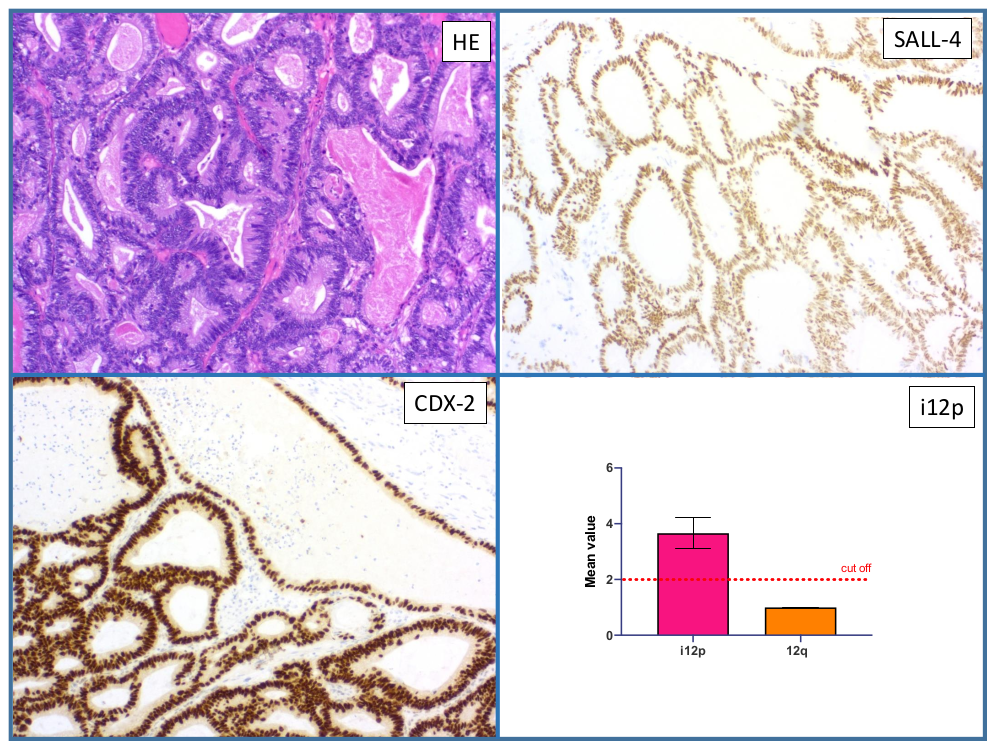
The invasive germ cell tumors are differentiated histologically and clinically into seminomas and non-seminomas. The group of non-seminomas includes embryonic carcinomas, yolk sac tumors, chorionic carcinomas and teratomas. The exact distinction of the histological types is of great importance for the further therapeutic procedure. We can use molecular changes (such as the appearance of an isochromome 12p, Figure 3) to prove the "germ cell tumor origin" in difficult cases and thus form the basis for further therapy for the clinical colleagues.
TGCT therapy consists of inguinal testicular removal and, depending on the clinical stage, subsequent chemotherapy. The mortality of the TGCT could be reduced significantly with the introduction of platinum derivatives. Even with metastatic TGCT, 80% of patients can be cured with cisplatin-based polychemotherapy. In contrast, cisplatin-resistant patients have a very poor prognosis. New therapeutic options for these patients are rare and only a few therapeutic agents have been found in the past decades.
The aim of our working group is to typify the different testicular tumors as best as possible, to detect possible resistance mechanisms in TGCT and to identify potential therapeutic starting points in refractory germ cell tumors.
Entstehung und Klassifizierung
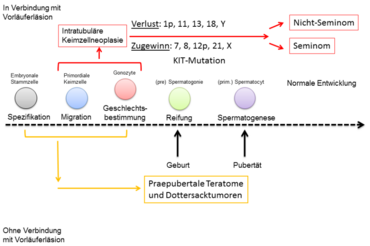
Als gesicherte Vorläuferläsion gilt die Keimzellneoplasie in situ (germ cell neoplasia in situ, GCNIS), bei der die Tumorzellen auf die Hodentubuli beschränkt bleiben. Durchbrechen atypische Keimzellen die Hodentubuli und infiltrieren das umliegende Gewebe, entstehen invasive Keimzelltumoren. Als Ursache für die Entstehung einer GCNIS wird angenommen, dass sich primordiale Keimzellen/ Gonozyten nicht in Spermatogonien differenzieren. Eine wichtige molekulare Veränderung ist dabei die Vermehrung von chromosomalem „Material“ auf Chromsom 12 meist in Form eines Isochromsoms 12p.
Von der GCNIS werden invasive Keimzelltumoren unterschieden. Die invasiven Keimzelltumoren werden histologisch und klinisch in Seminome und Nicht-Seminome unterschieden. Seminome und Nicht-Seminome bestehen aus transformierten Gonozyten und bilden neoplastische Zellverbände der embryonalen Entwicklung nach. Zur Gruppe der Nicht-Seminome zählen die embryonalen Karzinome, Dottersacktumoren, Chorionkarzinome und Teratome.
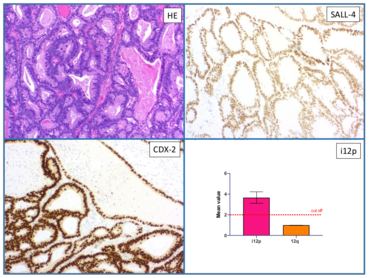
Seminome und nicht-seminomatöse Keimzelltumoren weisen ein unterschiedliches biologisches Verhalten auf. Reine Seminome zeigen im Vergleich zu nicht-seminomatösen Keimzelltumoren einen indolenten Verlauf, weswegen eine exakte Abgrenzung dieser Tumorgruppe für das weitere therapeutische Management unbedingt erforderlich ist.
Überwiegend kommen nicht-seminomatöse Keimzelltumoren als gemischte Keimzelltumoren vor. Gemischte Keimzelltumoren beinhalten definitionsgemäß mehr als einen der aufgeführten histologischen Typen. Sie repräsentieren 69% der nicht-seminomatösen und 32% aller Keimzelltumoren. Dabei lassen sich sehr häufig Anteile eines embryonalen Karzinoms nachweisen. Die Prognosekriterien bei nicht-seminomatösen Keimzelltumoren werden zurzeit kontrovers diskutiert. Einigkeit besteht allerdings darüber, dass die genaue Aufschlüsselung der histologischen Typen von großer Bedeutung ist. Molekulare Veränderung (wie z.B. das Auftreten eines Isochromsoms 12p) können wir dabei nutzen um bei schwierigen Fällen die „Keimzelltumorherkunft“ zu beweisen und den klinischen Kollegen somit die Grundlage für die weiterführende Therapie zu bilden.
Therapie
Die Therapie der TGCT besteht aus einer inguinalen Hodenentfernung und, je nach klinischem Stadium, einer anschließenden Chemotherapie. Die Mortalität der TGCT konnte mit der Einführung von Platinderivaten deutlich gesenkt werden. Selbst bei metastasierten TGCT können 80% der Patienten mit einer Cisplatin-basierten Polychemotherapie geheilt werden. Cisplatin-resistente Patienten haben dagegen eine sehr schlechte Prognose. Neue Therapieoptionen für diese Patienten sind selten und in den letzten Jahrzehnten konnten lediglich einige wenige Therapeutika gefunden werden.
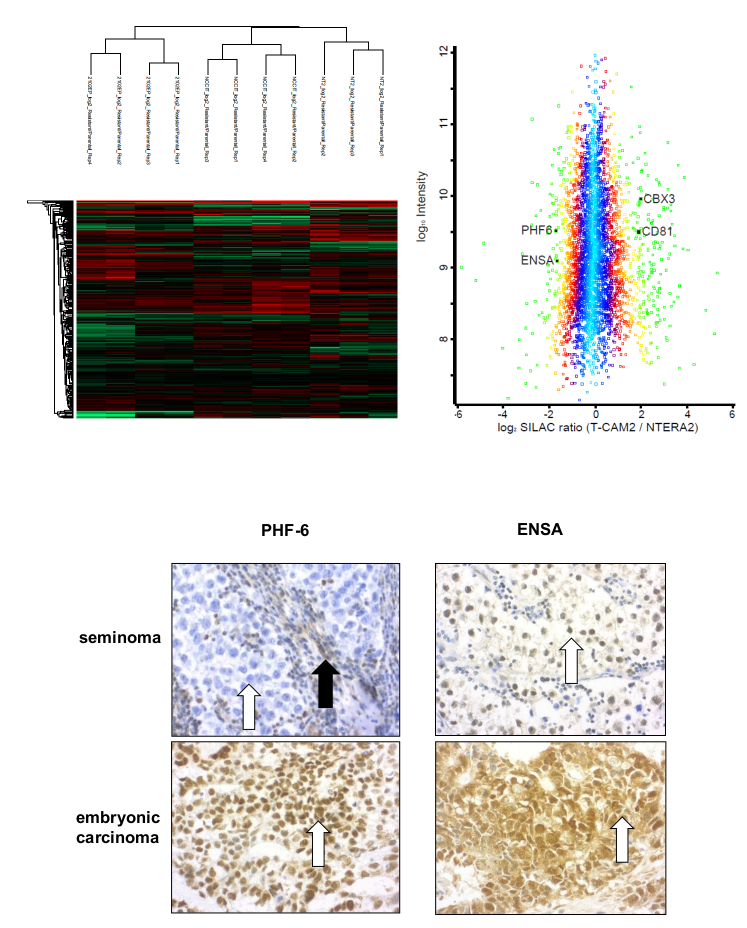
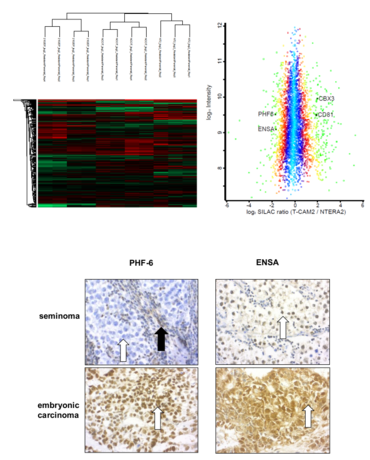
Mit Hilfe unterschiedlicher Zellkulturmodelle versuchen wir die Mechanismen der Cisplatinresistenz in Keimzelltumoren besser zu verstehen und somit mögliche therapeutische Ansatzpunkte zu finden. Dabei versuchen wir die Ergebnisse der in vitro Experimente auf humane Gewebeproben zu übertragen um hier in Zukunft eine bestmögliche Typisierung der Tumoren vornehmen zu können.
Ziel unserer Arbeitsgruppe ist es die verschiedenen Hodentumoren bestmöglich zu typisieren, mögliche Resistenzmechanismen in TGCT zu detektieren und potentielle therapeutische Ansatzpunkte in therapierefraktären Keimzelltumoren zu identifizieren.
Kooperationen
- Prof. Dr. Dr. Nadine Gaisa, Aachen
- PD Dr. Dr. Friedemann Honecker, St. Gallen
- PD. Dr. Silke Kaulfuß, Göttingen
- Prof. Dr. Daniel Nettersheim, Düsseldorf
- Dr. Christoph Oing, Hamburg
- PD Dr. Henning Reis, Essen
- PD Dr. Christoph Seidel, Hamburg
- Prof. Dr. Stefan Schweyer, Starnberg
Arbeitsgruppen
- Arbeitsgruppe Uropathologie der deutschen Gesellschaft für Pathologie
- Deutsche Hodentumorstudiengruppe
Mitgliedschaften
- Berufsverband Pathologie
- Internationale Akademie für Pathologie
- Deutscher Hochschulverband
- Deutsche Gesellschaft für Pathologie
Seminare
- Hodentumoren Lehrserie 325 der internationalen Akademie für Pathologie (https://www.iap-bonn.de/series/hodentumoren-3/?cat=553)
Geförderte Projekte
07/2013 bis 07/2016
Deutsche Forschungsgemeinschaft: „Einfluss der Östrogenrezeptoren auf den malignen Verlauf des Prostatakarzinoms dargestellt in neuen Estrogenrezeptor- knock out- TRAMP-Tiermodellen“ (GZ:BR 4700/1-1)
03/2014 bis 02/2016
Forschungsförderprogram 2013 der Universitätsmedizin Göttingen - Startförderung: „Analysen zur Funktion von N-Cadherin in Initiation, Progression und Therapieresistenz in malignen Keimzelltumoren des Hodens
12/2016 bis 03/2019
Wilhelm Sander Stiftung: „Identifizierung neuer therapeutischer Zielgene in Cisplatin resistenten Keimzelltumoren“ (2016.041.1)
06/2019 bis 05/2021
Wilhelm Sander Stiftung: „Identifizierung neuer therapeutischer Zielgene in Cisplatin resistenten Keimzelltumoren“ (2016.041.2)
Ausgewählte Publikationen
The detection of isochromosome i[12p] in malignant germ cell tumours and tumours with somatic malignant transformation using qPCR.
Fichtner A, Richter A, Filmar S, Gaisa NT, Schweyer S, Reis H, Nettersheim D, Oing C, Gayer FA, Leha A, Küffer S, Ströbel P, Kaulfuß S, Bremmer F. Histopathology. 2020 Sep
CDK4/6 inhibition presents as a therapeutic option for paediatric and adult germ cell tumours and induces cell cycle arrest and apoptosis via canonical and non-canonical mechanisms.
Skowron MA, Vermeulen M, Winkelhausen A, Becker TK, Bremmer F, Petzsch P, Schönberger S, Calaminus G, Köhrer K, Albers P, Nettersheim D. Br J Cancer. 2020 May
Human chorionic gonadotropin-positive seminoma patients: A registry compiled by the global germ cell tumor collaborative group (G3).
Seidel C, Daugaard G, Nestler T, Tryakin A, Fedyanin M, Fankhauser C, Hermanns T, Aparicio J, Heinzelbecker J, Paffenholz P, Heidenreich A, De Giorgi U, Cathomas R, Lorch A, Fingerhut A, Gayer F, Bremmer F, Giannatempo P, Necchi A, Aurilio G, Casadei C, Tran B, Dieckmann KP, Brito M, Ruf C, Oing C, Bokemeyer C. Eur J Cancer. 2020 Jun
Shallow whole genome sequencing of adenoid cystic carcinomas of the salivary glands identifies specific chromosomal aberrations related to tumor progression.
Cordesmeyer R, Laskawi R, Schliephake H, Kauffmann P, Beck J, Bornemann-Kolatzki K, Schütz E, Ströbel P, Kueffer S, Fichtner A, Bremmer F. Oral Oncol. 2020 Apr
Proteomic Comparison of Malignant Human Germ Cell Tumor Cell Lines.
Bremmer F, Bohnenberger H, Küffer S, Oellerich T, Serve H, Urlaub H, Strauss A, Maatoug Y, Behnes CL, Oing C, Radzun HJ, Ströbel P, Balabanov S, Honecker F. Dis Markers. 2019 Sep
Transcription factor TAp73 and microRNA-449 complement each other to support multiciliogenesis.
Wildung M, Esser TU, Grausam KB, Wiedwald C, Volceanov-Hahn L, Riedel D, Beuermann S, Li L, Zylla J, Guenther AK, Wienken M, Ercetin E, Han Z, Bremmer F, Shomroni O, Andreas S, Zhao H, Lizé M. Cell Death Differ. 2019 Dec
The role of beta-catenin mutation and SOX9 expression in sex cord-stromal tumours of the testis.
Bremmer F, Behnes CL, Schildhaus HU, Gaisa NT, Reis H, Jarry H, Radzun HJ, Stroebel P, Schweyer S. Virchows Arch. 2017 Apr
Kontakt
Kontaktinformationen
- Telefon: +49 551 3968708
- E-Mail-Adresse: felix.bremmer(at)med.uni-goettingen.de
Das könnte Sie auch interessieren