Redoxmetabolismus in Tumoren und Neuronen
AG Venkataramani
Rolle des Alzheimer Amyloid Vorläufer Protein (APP) im Eisen- und Redoxmetabolismus
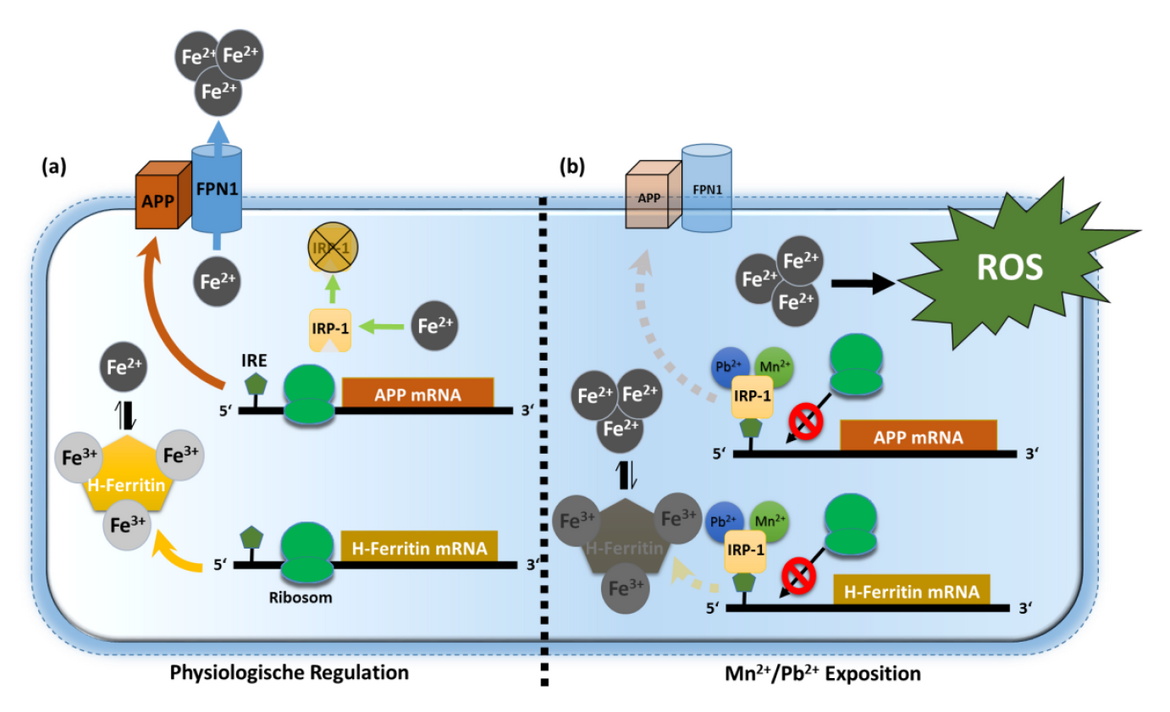
Das Amyloid-Vorläufer-Protein (amyloid precursor protein, APP) spielt in der Pathogenese der Alzheimerkrankheit eine essentielle Rolle. Hier wird das APP durch beta- und gamma-Sekretasen in A-beta-Peptide gespalten, die sich in Form löslicher Oligomere und fester Amyloidplaques intra- und extraneuronal akkumulieren. Jedoch wird das APP unter physiologischen Bedingungen in erster Linie „anti-amyloidogen“ prozessiert. Hier schneidet die alpha-Sekretase (ADAM10) das APP innerhalb der A-beta-Region, so dass ein großes lösliches Fragment, das sAPP-alpha in den Extrazellularraum freigesetzt wird. Im starken Kontrast zum neurotoxischen A-beta-Peptid hat das alpha-Sekretase-Spaltprodukt sAPP-alpha eine wachstumssteigernde, synaptotrophische und zellprotektive Wirkung in neuronalen und nicht neuronalen Zellen (Venkataramani et al., 2012b).
In neuronalen Zellkulturexperimenten als auch in diversen Tiermodellen konnten wir deutliche Hinweise finden, dass die APP-Expression durch den zellulären Eisengehalt reguliert wird. Ähnlich wie andere prominente Eisenregulatoren konnte auch in der mRNA von APP eine funktionsfähige homologe IRE (iron responsive element)-Konsensus-Sequenz nachgewiesen werden. Genau an dieser IRE-like-Sequenz kann der zentrale Eisenregulator IRP1 binden und die APP-Translation blockieren. Weiterhin konnte gezeigt werden, dass Schwermetalle wie Blei (Pb2+) und Mangan (Mn2+) diese inhibitorische IRE-Bindung verstärken und damit eine effektive APP-Proteintranslation blockieren. Der Verlust von APP führt zu einer dramatischen intrazellulären Akkumulation von redox-aktivem, zweiwertigem Eisen (Fe2+), welches sich auch in der Induktion von Lipidperoxidation widerspiegelt. Durch diesen neuen Erklärungsansatz für die APP-Funktion können nicht nur die erhöhten APP-Expressionsspiegel in oxidativ gestressten neuronalen Zellen und Gewebe erklärt werden, sondern auch Rückschlüsse gezogen werden, wie Zellen durch die Präsenz von APP vor oxidativem Stress geschützt werden (Venkataramani et al., 2018a).
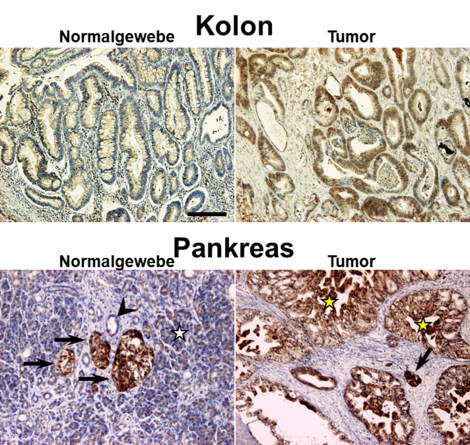
Unsere Arbeitsgruppe konnte bereits vor 10 Jahren nachweisen, dass APP neben Neuronen auch in diversen malignen Tumorentitäten, wie Pankreas-, Kolon- und testikulären Tumoren, hoch exprimiert wird (Venkataramani et al., 2010; Venkataramani et al., 2012a). Dies ist insofern interessant, da im Laufe der Tumorentwicklung große Mengen an Eisen benötigt werden und vermutlich hohe APP-Spiegel die zelltoxischen Eisenwirkungen abschwächen, um ein Überleben aggressiver Tumorzellen zu garantieren.
Belege für diese Hypothese konnten bereits in unveröffentlichten eigenen Arbeiten gefunden werden: Der genetische und pharmakologische Verlust von APP führt in multiplen Tumorzelllinen zu einer signifikanten Fe2+- Akkumulation, Lipidperoxidation und detriminaler oxidativer DNA-Schädigung in vitro, ex vivo und in vivo. Diese Ergebnisse heben APP als neue therapeutisch angreifbare Zielstruktur im Krebs hervor.
CE-ICP-MS: Eine neue Methode zur quantitativen Bestimmung von Fe2+- und Fe3+-Spezies im Gewebe und Körperflüssigkeiten
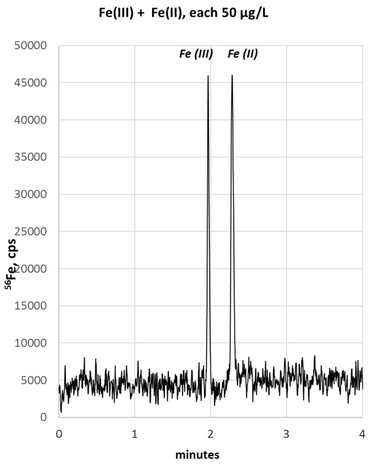
Der Eisenmetabolismus spielt bei diversen physiologischen Prozessen, wie Zellwachstum und Zellteilung, aber auch bei pathophysiologischen Prozessen, wie neurodegenerativen und malignen Erkrankungen, eine zentrale Rolle. Zellbiologisch kann das Totaleisen in einen „stabilen“ und „labilen“ Eisenpool (labile iron pool, LIP) unterteilt werden. Unter dem „stabilen“ Eisenpool versteht man, dass Eisen in thermodynamisch stabilen Komplexen (zum Beispiel Metal-Chaperonen) gebunden vorliegt, während der „labile“ Eisenpool das lose gebundene, zytoplasmatische Eisen (Fe2+) darstellt, welches leicht freigesetzt werden kann und dann bei zahlreichen Redox-Reaktionen involviert ist.
In enger Zusammenarbeit mit der Arbeitsgruppe von Prof. Bernhard Michalke (Helmholtz-Zentrum München) wurde die CE-ICP-MS (Capillary Electrophoresis Coupled to Inductively Coupled Plasma Mass Spectrometry) entwickelt, womit simultan und quantitativ Fe2+ und Fe3+ in präklinischen und klinischen Proben bestimmt werden kann. Verglichen zur Alternativmethode LC-ICP-MS bietet die neue Methode mehrere Vorteile bei gleicher Zuverlässigkeit der Messergebnisse. Aktuelle Studien werden zeigen, ob man durch eine quantitative Fe2+-/Fe3+-Bestimmung in biologischen Proben (Zelllysate, Liquor-, Tumorproben) Aussagen über das Ausmaß einer Fe2+-vermittelten Gewebeschädigung (Biomarker für „tissue at risk“) treffen kann (Michalke et al., 2019; Michalke et al., 2020).
Siehe die Video-Erklärung der Methode: https://www.jove.com/v/61055/setup-capillary-electrophoresis-inductively-coupled-plasma-mass
Oxidativer Stress als therapeutischer Angriffspunkt in seltenen Weichgewebstumoren
Sarkome sind seltene bösartige Tumore, die ca. 1 % aller malignen Tumore im Erwachsenenalter ausmachen. Sarkome entstehen aus dem Weichteilgewebe, wie Binde-, Muskel-, Fettgewebe oder Knochen, und können dementsprechend in mehr als 170 verschiedene Typen unterteilt werden. Das Angiosarkom ist mit etwa 1 bis 2 % aller Weichteilsarkome ein sehr seltener hochmaligner Tumor, der entweder von den Blutgefäßen (Hämangiosarkom) oder von den Lymphgefäßen ausgeht (Lymphangiosarkom) und kann dementsprechend an jedem Ort des Körpers entstehen.
Die Prognose von Angiosarkomen ist mit durchschnittlich 51 Monaten im lokalisierten Stadium und mit 12 Monaten im metastasierten Stadium im Allgemeinen als sehr schlecht zu werten. Derzeit stehen neben der chirurgischen Entfernung, die Strahlen- und Chemotherapeutika (wie Paclitaxel, Doxorubicin und Darcabazin) als Behandlungsoptionen zur Verfügung. Jedoch sprechen Angiosarkome, die nur inkomplett reseziert werden konnten, nur mäßig bis schlecht auf eine kombinierte Radiochemotherapie an.
Der Oberflächenmarker CD31 ist ein Transmembranprotein, welches auf Endothelzellen, Thrombozyten und Immunzellen zu finden ist. Die biologische Funktion von CD31 im Angiosarkom ist jedoch bislang unklar gewesen. Interessanterweise konnten wir immunhistochemisch in Patienten sowie in drei etablierten humanen Angiosarkomzelllinien (ASM, ISO-HASc.1 und HAMON) eine heterogene CD31-Expression nachweisen. Während Angiosarkomzellen mit hohen CD31-Spiegeln (CD31high) morphologisch normalen Endothelzellen ähneln („Pflasterstein“-Morphologie), zeigten die CD31low-Zellen eine „spindelförmige“ fibroblasten- artige Morphologie auf. Diese CD31low-Zellen zeigen nicht nur eine deutlich höhere Tumorigenität auf, sondern sind auch therapie-resistent gegenüber konventionelle Chemotherapeutika.
Auf molekularer Ebene konnten wir nachweisen, dass der Verlust von CD31 den Abbau des Hippopathway-Regulators YAP (yes-associated protein) unterbindet. Neben der onkogenen Funktion von YAP konnte weiterhin gezeigt werden, dass YAP ein Sortiment von anti-oxidativen Zielgenen wie Katalase und Thioredoxin induziert. Diese eliminieren äußerst effektiv toxische Sauerstoffradikale und vermindern so oxidativen Stress. Basierend auf diesen Evidenzen, dass YAP eine mögliche Zielstruktur in den aggressiven CD31low-Zellen darstellt, wird derzeit die therapeutische Relevanz näher untersucht (Venkataramani et al., 2018b).
Ausgewählte Publikationen
- Michalke, B., Willkommen, D., and Venkataramani, V. (2019). Iron Redox Speciation Analysis Using Capillary Electrophoresis Coupled to Inductively Coupled Plasma Mass Spectrometry (CE-ICP-MS). Frontiers in Chemistry 7.
- Michalke, B., Willkommen, D., and Venkataramani, V. (2020). Setup of Capillary Electrophoresis-Inductively Coupled Plasma Mass Spectrometry (CE-ICP-MS) for Quantification of Iron Redox Species (Fe(II), Fe(III)). J Vis Exp.
- Venkataramani, V., Doeppner, T.R., Willkommen, D., Cahill, C.M., Xin, Y., Ye, G., Liu, Y., Southon, A., Aron, A., Au-Yeung, H.Y., et al. (2018a). Manganese causes neurotoxic iron accumulation via translational repression of amyloid precursor protein and H-Ferritin. J Neurochem 147, 831-848.
- Venkataramani, V., Küffer, S., Cheung, K.C.P., Jiang, X., Trümper, L., Wulf, G.G., and Ströbel, P. (2018b). CD31 Expression Determines Redox Status and Chemoresistance in Human Angiosarcomas. Clin Cancer Res 24, 460-473.
- Venkataramani, V., Rossner, C., Iffland, L., Schweyer, S., Tamboli, I.Y., Walter, J., Wirths, O., and Bayer, T.A. (2010). Histone deacetylase inhibitor valproic acid inhibits cancer cell proliferation via down-regulation of the alzheimer amyloid precursor protein. J Biol Chem 285, 10678-10689.
- Venkataramani, V., Thiele, K., Behnes, C.L., Wulf, G.G., Thelen, P., Opitz, L., Salinas-Riester, G., Wirths, O., Bayer, T.A., and Schweyer, S. (2012a). Amyloid Precursor Protein Is a Biomarker for Transformed Human Pluripotent Stem Cells. Am J Pathol.
- Venkataramani, V., Wirths, O., Budka, H., Hartig, W., Kovacs, G.G., and Bayer, T.A. (2012b). Antibody 9D5 recognizes oligomeric pyroglutamate amyloid-beta in a fraction of amyloid-beta deposits in Alzheimer's disease without cross-reactivity with other protein aggregates. J Alzheimers Dis 29, 361-371.
Publikationslisten
https://scholar.google.com/citations?user=TBT4ZR0AAAAJ&hl=en
https://www.researchgate.net/profile/Vivek_Venkataramani/publications
https://pubmed.ncbi.nlm.nih.gov/?term=Venkataramani%20Vivek&sort=date
Presseartikel zu unserer Forschung
Alzheimer/Krebs
- https://www.hna.de/lokales/goettingen/neuer-ansatz-krebstherapie-2672917.html
- https://www.aerzteblatt.de/foerderpreise/verleihung?id=2304
Angiosarkom
Kontakt
contact information
- telephone: +49 551 3920643
- e-mail address: ramani(at)med.uni-goettingen.de
Kooperationen
- Thorsten R. Döppner, Department of Neurology, UMG
- Stefan Nessler, Institute of Neuropathology, UMG
- Ralph Krätzner, Henry G. Klemp und Sven Thoms, Department of Neuropediatrics, UMG
- Bernhard Michalke, Helmholtz Zentrum München
- Hamed Alborzinia, HI-STEM, DKFZ, Heidelberg
- Kostas Pantopoulos, Lady Davis Institute, Department of Medicine, McGill University, Canada
- Ashley I. Bush, The Florey Institute of Neuroscience and Mental Health, Melbourne, Australia
- Michael Aschner, Albert Einstein College of Medicine, New York, United States
- Ashraf Ibrahim, David Geffen School of Medicine UCLA, United States
- Patrizia Agostinis, VIB-KU Leuven Center for Cancer Biology, Leuven, Belgium
Das könnte Sie auch interessieren